武汉贝茵莱生物科技有限公司
入驻年限:10 年
- 联系人:
黄经理
- 所在地区:
湖北 武汉市
- 业务范围:
试剂、医疗器械、技术服务、耗材、实验室仪器 / 设备、书籍 / 软件、原辅料包材、细胞库 / 细胞培养
- 经营模式:
生产厂商 经销商 科研机构 代理商
推荐产品
新闻中心/正文
Gut(IF=32)香烟烟雾通过调节肠道微生物群和相关代谢物促进结直肠癌
人阅读 发布时间:2023-06-05 10:48

肠道微生物学TOP期刊《Gut》
/文献名称/
Cigarette smoke promotes colorectal cancer through modulation of gut microbiota and related metabolites
/中文名称/
香烟烟雾通过调节肠道微生物群和相关代谢物促进结直肠癌

本研究发现与无烟对照小鼠相比,暴露于香烟烟雾的小鼠肿瘤发病率和细胞增殖显著增加,且其肠道微生物生态失调,细菌种类丰度存在显著差异。在烟雾暴露的小鼠中,Eggerthella lenta的富集与牛磺脱氧胆酸(TDCA)最具正相关。研究还揭示,暴露于烟雾的小鼠表现出增强的致癌MAPK / ERK(丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶1/2)信号传导(TDCA的下游靶标)和肠道屏障功能受损。
研究表明,用烟雾暴露小鼠(GF-AOMS)粪便移植的无菌小鼠增加结肠细胞增殖,GF-AOMS显示肠道E. lenta和TDCA丰度增加,结肠上皮肠道屏障受损,激活MAPK / ERK途径。
研究结果表明,香烟烟雾诱导的肠道微生物群失调在结直肠癌中起促肿瘤作用。烟雾诱导的肠道微生物群失调改变了肠道代谢产物,损害了肠道屏障功能,从而激活结肠上皮的致癌MAPK / ERK信号传导。
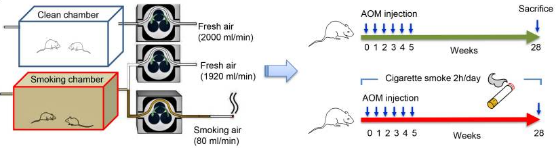
研究背景
结直肠癌(CRC)是全球最常见的癌症之一。尽管有许多早期CRC筛查和预防策略,但预计其负担将进一步增加[1]。有证据支持饮食、吸烟、肥胖和运动等生活方式与CRC的关联[2]。
吸烟会增加患肺癌的风险,大约80%的原发性肺癌可归因于吸烟[3]。吸烟还会增加不直接暴露于香烟烟雾的其他器官患癌症的风险,例如结肠、直肠、胰腺和肾脏[4]。研究表明,吸烟与人类CRC发病率和死亡率显著相关,且在动物模型中也有此发现[5,6]。然而,吸烟促进CRC启动和进展的机制尚不清楚。在人类戒烟后发现细菌多样性增加[7,8],有研究还表明,微生物组和粘蛋白结构的改变也与吸烟有关[9]。这更加确立肠道微生物群改变与CRC的关联[10-13]。来自CRC患者的肠道微生物可以促进受体小鼠的结肠肿瘤发生[11]。然而,肠道微生物群的改变是否代表(represents)吸烟和CRC之间的联系仍然难以捉摸。
在这项研究中,我们旨在使用常规和无菌小鼠模型确定吸烟在CRC发展中的作用。我们证明吸烟可以通过诱导肠道微生物群生态失调来促进CRC,同时这也会影响代谢物,特别是TDCA。肠道TDCA升高可激活结肠上皮致癌MAPK/ERK(丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶1/2)通路,进而促进结肠细胞增殖。此外,吸烟可能会损害肠道屏障功能,从而进一步促进TDCA激活结肠致癌MAPK / ERK信号传导。
研究结果
1、香烟烟雾促进小鼠结直肠肿瘤发生
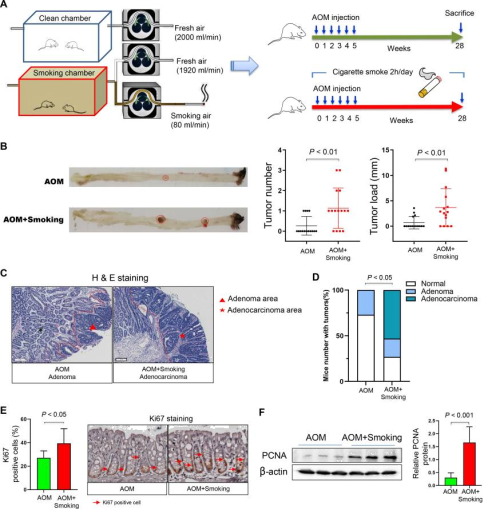
Figure 1.
Cigarette smoking increases colorectal tumourigenicity in mice.
将AOM处理的C57BL / 6小鼠暴露于清洁空气或香烟烟雾中。香烟烟雾暴露小鼠的结直肠肿瘤数量和肿瘤大小均明显大于无烟雾对照小鼠,显著增加结肠肿瘤的发病率。此外,还发现与无烟雾对照小鼠相比,香烟烟雾暴露的小鼠结肠上皮细胞增殖加快,表现为Ki-67阳性细胞数量显著增加和细胞增殖蛋白标志物增殖细胞核抗原(PCNA)的表达水平升高。这些结果说明香烟烟雾促进小鼠结直肠肿瘤发生。
2、香烟烟雾改变小鼠肠道微生物群组成和微生物相互作用
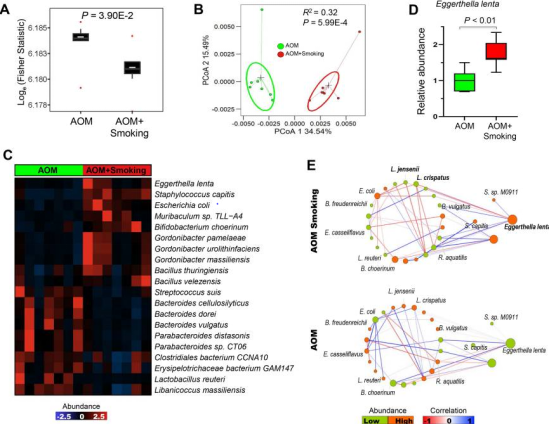
Figure 2. Cigarette smoke modulates the gut microbiota of mice.
本研究用16S测序和宏基因组鸟枪法测序技术观察暴露在烟雾和无烟对照小鼠之间粪便微生物群的差异。如图2所示,在基线(初始时间点)时,暴露在烟雾和无烟对照小鼠之间的微生物组在α和β多样性方面没有显著差异。28周后,发现与无烟对照小鼠相比,香烟烟雾暴露小鼠的α多样性显著降低。PCoA分析(β多样性)显示,与无烟对照小鼠相比,暴露于烟雾小鼠肠道微生物群聚类显著不同,E. lenta、Staphylococcus capitis、Lactobacillus reuteri、Parabacteroides distasonis和Bacteroides dorei等20个细菌在香烟烟雾暴露小鼠中发生显著改变,特别是E. lenta丰度在香烟烟雾暴露小鼠中更高。
此外,本研究对细菌之间相互作用的生态网络观察,发现这些细菌在暴露烟雾小鼠和无烟对照小鼠共生和共排除相互作用存在显著差异。E. lenta和Lactobacillus jensenii 、Lactobacillus crispatus两种益生菌之间有共斥相关性,提示富集的E. lenta与香烟烟雾暴露小鼠中耗尽的保护细菌拮抗关联。
3、香烟烟雾改变粪便中肠道微生物群相关代谢物
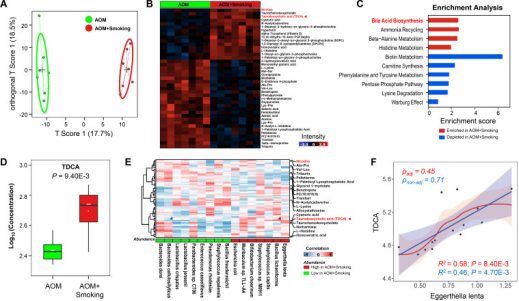
Figure 3. Cigarette smoke alters gut microbiota-related metabolites in stool.
本研究通过液相色谱与质谱(MS)/MS分析测定小鼠粪便烟雾暴露后粪便代谢物的改变。正交偏最小二乘判别分析表明,暴露烟雾小鼠的粪便代谢谱与无烟小鼠的粪便代谢特征存在显著差异。与无烟对照小鼠相比,香烟烟雾暴露小鼠粪便中41种代谢物发生改变,改变的代谢物在不同的代谢组学信号通路中富集或耗尽。与无烟小鼠相比,胆汁酸生物合成是香烟烟雾暴露小鼠中富集度最高的途径。在暴露于烟雾的小鼠中,TDCA的丰度显著增加。此外,通过对细菌和代谢物之间相关性分析。我们发现E. lenta与TDCA的正相关关系最强。与无烟小鼠相比,暴露于烟雾小鼠编码3β-HSDH酶基因丰度显著更高。进一步证实,E. lenta丰度与粪便TDCA浓度呈正相关。以上结果表明,肠道微生物生态失调和改变的代谢物可能共同作用,促进结肠肿瘤的发生。
4、香烟烟雾损害肠道屏障功能
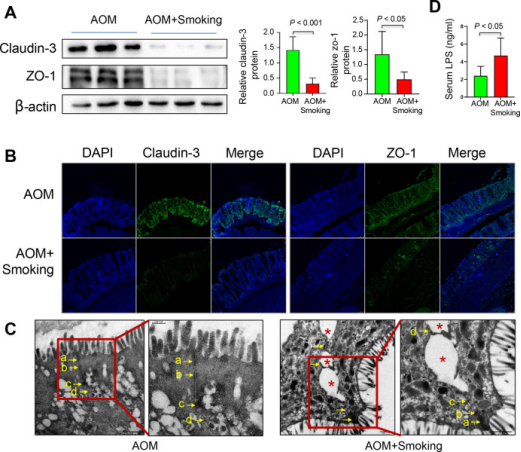
Figure 4. Cigarette smoke impairs the gut barrier function.
为了研究吸烟对肠道屏障功能的影响,本研究分析claudin-3和ZO-1表达水平以及血清脂多糖(LPS)的表达水平。WB与免疫荧光染色结果显示,香烟烟雾显著降低claudin-3和ZO-1水平。同时,本研究还发现与无烟小鼠相比,烟雾暴露小鼠的血清LPS水平显著增加。这些结果共同表明,香烟烟雾会导致肠道屏障功能受损。
5、香烟烟雾增强结肠上皮致癌的MAPK/ERK信号传导
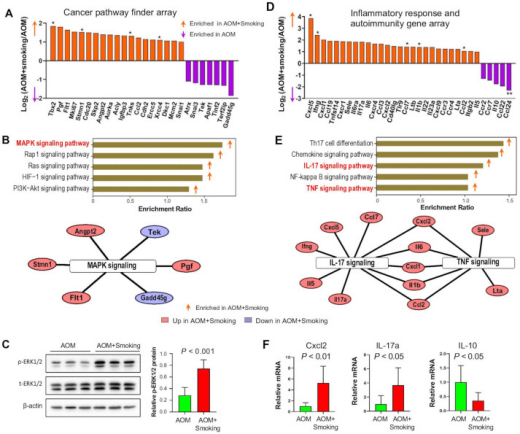
Figure 5. Cigarette smoke enhances the expression of oncogenic MAPK/ERK pathway and proinflammatory pathway in colonic epithelium.
为了解吸烟促肿瘤作用的分子见解,本研究分析结肠上皮癌症相关基因的表达。研究发现,与无烟对照小鼠相比,我们在烟雾暴露小鼠中观察到19个上调基因和7个下调基因(图5A)。富集分析表明,丝裂原活化蛋白激酶(MAPK)信号通路是香烟烟雾激活的最大通路(图5B)。此外,磷酸化ERK1/2是MAPK/ERK途径中的关键介质蛋白,本研究发现烟雾暴露小鼠中磷酸化ERK1/2水平升高(图5C),这再次证实吸烟激活MAPK / ERK信号传导。同时,也观察到ERK磷酸化水平与TDCA水平之间存在正相关。这些研究表明,香烟烟雾诱导ERK1/2磷酸化并激活MAPK/ERK信号通路以促进结肠肿瘤发生。
6、香烟烟雾增强促炎信号基因的表达
肠道细菌生态失调与炎症密切相关,炎症与致癌因素和肿瘤发生有关。因此,我们使用小鼠炎症反应和自身免疫PCR阵列分析促炎基因的表达。结果显示,与无烟对照小鼠相比,香烟烟雾暴露小鼠中观察到27个上调基因和5个下调基因(图5D)。而且香烟烟雾诱导包括促炎白细胞介素17(IL-17)信号传导和肿瘤坏死因子(TNF)信号传导途径在内的途径改变(图5E)。定量逆转录PCR(RT-PCR)证实,与无烟对照小鼠相比,烟雾暴露小鼠中促炎IL-17a、Cxcl2的表达增加和抗炎IL-10的表达降低(图5F)。此外,研究还发现IL-17a的相对mRNA表达与结肠中E. lenta的丰度呈正相关。这些发现表明,香烟烟雾会促进结肠肿瘤发生的炎症。
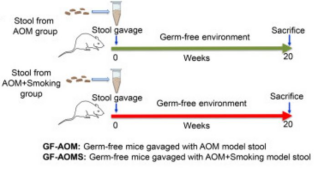
7、无菌小鼠粪便微生物群移植重现烟雾暴露常规小鼠肠道微生物群的改变
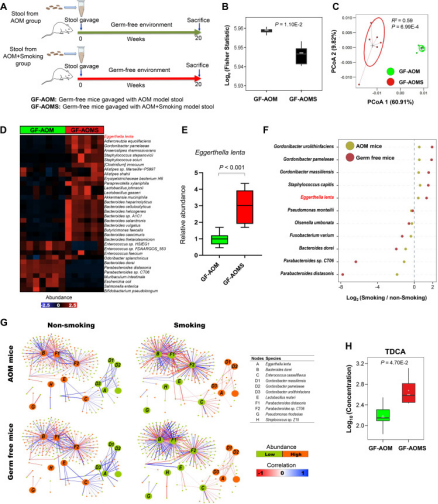
Figure 6. Alteration of gut microbiota in germ-free mice with faecal microbiota transplantation from smoke-exposed conventional mice.
为了证实香烟烟雾改变肠道微生物群对结直肠肿瘤发生的直接作用,我们在无菌小鼠中进行了粪便微生物群移植。研究发现,与无烟小鼠粪便管饲(GF-AOM)相比,用香烟烟雾暴露小鼠粪便管饲的无菌小鼠(GF-AOMS)的α多样性显著降低。β多样性分析再次显示这两组无菌小鼠之间的肠道微生物群显著分离。GF-AOMS小鼠的E. lenta丰度显著增加,而P. distasonis显著降低。通过定量PCR证实GF-AOMS组的E. lenta丰度显著高于GF-AOM组。
此外,我们发现,与无烟AOM小鼠相比,烟雾暴露AOM小鼠丰度增加的细菌在GF-AOMS小鼠中持续增加,而与GF-AOM小鼠相比,烟雾暴露AOM小鼠中丰度降低的细菌在GF-AOMS小鼠中持续减少。重要的是,我们观察到在暴露于烟雾的AOM小鼠和GF-AOMS小鼠中,E. lenta的丰度增加,而益生菌P. distasonis的丰度较低。相关性分析显示,与供体小鼠相比,无菌小鼠粪便移植后生态网络模块保守。此外,与GF-AOM小鼠相比,GF-AOMS的粪便TDCA水平也显著增加。综上,无菌小鼠粪便微生物群移植重现烟雾暴露常规小鼠肠道微生物群的改变。
8、香烟烟雾改变的微生物群增加无菌小鼠的结肠细胞增殖和肿瘤发生
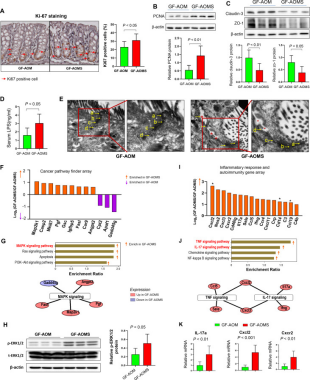
Figure 7. Altered microbiota by cigarette smoke increases colonocyte proliferation, impaired gut barrier function and enhances oncogenic MAPK/ERK and proinflammatory genes expression in germ-free mice.
与GF-AOM小鼠相比,GF-AOMS小鼠结肠上皮细胞增殖增加,这表现为Ki-67阳性细胞比例较高(图7A)和PCNA表达水平较高(图7B)。此外,我们在无菌小鼠中进行AOM治疗,并用香烟烟雾暴露(GFAOM-AOMS)或无烟小鼠(GFAOM-AOM)的粪便灌胃。与GFAOM-AOM小鼠相比,GFAOM-AOMS小鼠结肠肿瘤数量和肿瘤大小显著增加。无菌小鼠的这些结果与常规小鼠的观察结果一致,因此表明香烟烟雾改变的微生物群和代谢组可以直接促进结肠细胞增殖和肿瘤发生。
9、香烟烟雾改变的微生物群会损害无菌小鼠的肠道屏障功能
本研究探究香烟烟雾改变的微生物群是否会影响无菌小鼠的肠道屏障功能。我们观察到GF-AOMS小鼠中claudin-3和ZO-1的表达降低以及血清LPS水平升高(图7C,D)。病理切片也证实了GF-AOMS小鼠肠道屏障功能受损,其显示顶端连接复合物和结肠细胞旁间隙中的细胞间连接扩大(图7E)。无菌小鼠的这些结果与常规小鼠一致,因此表明香烟烟雾改变微生物群和代谢组可能会损害肠道屏障功能,从而可能进一步促进肿瘤发生。
10、香烟烟雾改变的微生物群增强了无菌小鼠结肠上皮中的致癌MAPK / ERK途径
为了证实香烟烟雾改变的微生物群促进结肠细胞增殖的分子机制,我们对粪便管饲无菌小鼠的结肠上皮进行癌症通路查找阵列。与GF-AOM小鼠相比,本研究发现在GF-AOMS小鼠中9个上调基因和3个下调基因(图7F)。这些差异表达基因主要富集于MAPK/ERK信号通路。与GF-AOM小鼠相比,GF-AOMS小鼠中磷酸化ERK1 / 2的蛋白表达升高证实了MAPK / ERK信号传导的激活(图7G,H)。此外,本研究还观察到ERK磷酸化水平与TDCA水平之间存在正相关。同样,使用炎症反应和自身免疫PCR阵列,发现与GF-AOM小鼠相比,GF-AOMS中有16个促炎基因上调(图7I),这些基因也主要富集在TNF和IL-17信号通路中(图7J)。与GF-AOM小鼠相比,TNF和IL-17通路中的关键促炎基因(包括Il-17a和C-X-C基序趋化因子配体2(Cxcl2))和C-X-C基序趋化因子受体2(Cxcr2)在GF-AOMS小鼠中上调(图7K)。来自常规和无菌小鼠模型的一致发现表明,香烟烟雾改变的微生物群直接诱导结肠促炎TNF和IL-17信号传导以及致癌MAPK / ERK信号传导。因此,肠道微生物群的改变有助于香烟烟雾在结直肠癌变中的促肿瘤作用。
研究结论
总之,这项研究首次证明,香烟烟雾通过诱导肠道微生物群失调来促进结肠肿瘤的发生。烟雾诱导的肠道微生物群失调可以增加结肠中的TDCA水平,从而激活结肠上皮中的致癌MAPK / ERK、IL-17和TNF信号通路。此外,由肠道微生物群失调引起的肠道屏障功能障碍可能进一步促进TDCA激活MAPK / ERK信号通路。也表明戒烟是至少是通过重建健康的肠道微生物组来预防CRC的实用方法之一。
参考文献:
[1] Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics, 2020. CA Cancer J Clin 2020;70:145–64.
[2] Carr PR, Weigl K, Edelmann D, et al. Estimation of absolute risk of colorectal cancer based on healthy lifestyle, genetic risk, and colonoscopy status in a population-based study. Gastroenterology 2020;159:129–38.
[3] Ezzati M, Lopez AD. Estimates of global mortality attributable to smoking in 2000. Lancet 2003;362:847–52.
[4] Gandini S, Botteri E, Iodice S, et al. Tobacco smoking and cancer: a meta-analysis. Int J Cancer 2008;122:155–64.
[5] Botteri E, Iodice S, Bagnardi V, et al. Smoking and colorectal cancer: a meta-analysis. JAMA 2008;300:2765–78.
[6] Kim M, Miyamoto S, Sugie S, et al. A tobacco-specific carcinogen, NNK, enhances AOM/DSS-induced colon carcinogenesis in male A/J mice. In Vivo 2008;22:557–63.
[7] Biedermann L, Zeitz J, Mwinyi J, et al. Smoking cessation induces profound changes in the composition of the intestinal microbiota in humans. PLoS One 2013;8:e59260.
[8] Biedermann L, Brülisauer K, Zeitz J, et al. Smoking cessation alters intestinal microbiota: insights from quantitative investigations on human fecal samples using fish. Inflamm Bowel Dis 2014;20:1496–501.
[9] Allais L, Kerckhof F-M, Verschuere S, et al. Chronic cigarette smoke exposure induces microbial and inflammatory shifts and mucin changes in the murine gut. Environ Microbiol 2016;18:1352–63.
[10] Yu J, Feng Q, Wong SH, et al. Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer. Gut 2017;66:70–8.
[11] Wong SH, Zhao L, Zhang X, et al. Gavage of Fecal Samples From Patients With Colorectal Cancer Promotes Intestinal Carcinogenesis in Germ-Free and Conventional Mice. Gastroenterology 2017;153:1621–33.
[12] Tsoi H, Chu ESH, Zhang X, et al. Peptostreptococcus anaerobius induces intracellular cholesterol biosynthesis in colon cells to induce proliferation and causes dysplasia in mice. Gastroenterology 2017;152:1419–33.
[13] Scott AJ, Alexander JL, Merrifield CA, et al. International cancer microbiome Consortium consensus statement on the role of the human microbiome in carcinogenesis. Gut 2019;68:1624–32.
*本文由华中农业大学无菌动物团队郑季霞老师供稿,特此感谢!原创内容版权归原作者所有,未经授权禁止转载。
—THE END—
贝茵莱生物可提供肠道微生物相关的检测试剂产品,相关产品或靶标如下:
| 靶标/产品名称 |
货号 |
| Ki67 Polyclonal Antibody |
|
| Ki67 Mouse Monoclonal Antibody |
|
| PCNA Polyclonal Antibody |
|
| Claudin 3 Rabbit Monoclonal Antibody | RMAB49142 |
| ZO-1 Polyclonal Antibody | PAB46092 |
| β-actin Monoclonal Antibody | MAB48206 |
| ERK1/2 Rabbit Monoclonal Antibody | RMAB50690 |
| Phospho-ERK1/2 (Tyr222/Tyr205) Mouse Monoclonal Antibody |
MAB50815 |
| Mouse PCNA Associated Factor 15kDa(PAF)ELISA Kit | MU32763 |
| Lipopolysaccharides(LPS) | 可定制 |
| p-ERK1/2 | MAB50815 |







